Bom dia alunos !!!
Na última aula conversamos bastante sobre os modelos atômicos que tivemos antes de chegar no átomo que conhecemos hoje!
A primeira forma em explicar o que seria o que hoje conhecemos como átomo surgiu na Grécia por
Leucipo e Demócrito. Nesta época poucos acreditavam que os átomos de fato existiam, porém Leucipo e Demócrito mostravam já uma idéia primitiva de que os átomos existiam. Eles diziam que os materiais encontrados na natureza eram formados por partículas muito pequenas,invisíveis e indivisíveis!
Este modelo durou tempo considerável até que em 1808, o inglês
John Dalton elaborou a primeira TEORIA ATÔMICA.
Dalton dizia que a matéria é formada por átomos, que são
esferas maciças, indivisíveis, imutáveis e que não podem ser criadas , nem destruídas. Ele também percebeu que os átomos poderiam se unir, formando novas substâncias!
Logo após, tivemos a Teoria Atômica de
Thompson em 1898. Thompson percebeu que quando se esfrega uma caneta algumas vezes no cabelo, ela fica eletricamente carregada e atrai pequenos pedaços de papel. Se a caneta pode ser carregada, é porque seu átomos, por sua vez, possuem carga. Foi pensando desta maneira que Thompson chegou a conclusão que os átomos não eram indivísíveis, conforme era dito nos ultimos pensamentos sobre o átomo! Tinha alguma coisa presente nos átomos que permitia que estes pequenos pedaços de papel fossem atraídos!
Thompson chegou a conclusão, com esta experiencia e outras mais complexas, de que o átomo possuía pequenas partículas de carga negativa :
os elétrons!
O modelo químico de Thompson é conhecido como Pudim de Passas.

Modelo Atômico de Thompson - Pudim de Passas.
Em 1908,
Ernest Rutherford realizou uma experiência para mostrar que o átomo realmente era como Thompson dizia. Rutherford utilizou um material radioativo que emitia partículas ALFA , que por sua vez possuem carga positiva.
Ele esperava que as partículas alfa atravessassem a lâmina diretamente ,porém algumas foram rebatidas.
Como algumas partículas foram rebatidas, a explicação que o Rutherford encontrou é que elas deveriam ter se chocado com algo e, provavelmente,com algo de massa superior que a fizesse bater e voltar. Essa região foi denominada
NÚCLEO.
Se a partícula alfa possui carga positiva e ao chegar no núcleo a mesma foi "repelida", isto significa que o núcleo também possui carga positiva. E os elétrons então estariam ao redor do núcleo em uma área muito superior do que a área do núcleo, pois foram poucas as partículas que rebateram em sua experiência.
Porém Bohr, já havia concordado com o modelo de Rutherford, mas entendeu que este modelo precisava ser aprimorado em alguns aspectos.
Bohr percebeu que os elétrons não estavam dispersos no átomo ao redor do núcleo como dizia Rutherford.
Afirmou que os elétrons estavam em órbitas circulares denominadas camadas ou níveis de energia.
Ele percebeu também que enquanto ele gira,ele se mantém na mesma camada. Porém se o elétron fica excitado, ele pula para um nível de energia mais externo. Esta situação é extremamente instável, assim, logo ele volta para um nível inferior de energia, portanto uma camada mais interna, e libera aquela energia em excesso em forma de luz ! Este é o modelo atual, denominado Modelo Atômico de
Rutherford-Bohr
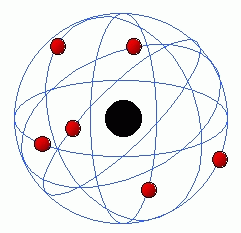
também conhecido como Modelo Planetário.
Aprendemos também que no núcleo do átomo, nós temos os neutrôns, de carga neutra e os prótons, que dão o caráter de carga positiva do núcleo.
Os elétrons, no átomo, estariam nas órbitas, e sua região de presença é denominada ELETROSFERA!
Além disso vimos alguns casos de
NOMENCLATURA QUÍMICA. Aprendemos que todos os elementos da tabela períodica, ou seja, os elementos que conhecemos da Terra, possuem por sua vez um número atômico e um número de Massa..
No vestibular, o número atômico estará embaixo do símbolo do elemento, e o numero de massa acima (ao contrário da tabela períodica de nossa apostila).
O número atômico, representado pela letra Z, corresponde ao número de prótons, que em um átomo neutro, ou seja, que não está perdendo nem ganhando elétrons, este número de protons será igual ao número de elétrons! Em átomos NAO NEUTROS, aprenderemos a calcular o numero de elétrons na próxima aula.
Aprendemos também que a massa de um elemento químico se concentra principalmente no núcleo. Ou seja, quem dá a massa dos elementos, sao as partículas que se encontram no núcleo, que sabemos que são os prótons e neutrons. Portanto a formula da massa é M= Prótons + Neutrons!
O valor da massa fica acima do nome do elemento nas tabelas períodicas em geral, o número de prótons é o número atômico, que fica abaixo do elemento na tabela períodica, assim, podemos calcular o número de neutrons, dentre outras continhas pequenas que são exigidas no vestibular e que exercitaremos em aula daqui para frente!
É importante lembrar também que o número da Massa é representado pela letra A!
Esta foi nossa aula da semana passada! Qualquer dúvida, postem aqui, ou me perguntem na quinta feira!!!
Bons estudos alunos!!!
Prof. Ana

 também conhecido como Modelo Planetário.
também conhecido como Modelo Planetário.