Primeiramente queria me desculpar com vocês com o tempinho que fiquei sem postar aqui.
Estava com uma certa sobrecarga de trabalho, mas esta semana irei postar tudo que está faltando para vocês.
O tema de hoje é: Propriedades Periódicas.
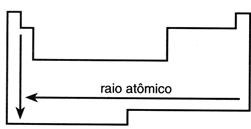
A primeira propriedade periódica que vamos estudar é o RAIO ATÔMICO!
Para que seja possível discutir a propriedade periódica do raio atômico, vamos considerar o átomo uma esfera, portanto o raio atômico será a distância do núcleo até o eletron mais externo.
Quando aumentamos o número de camadas do diagrama de Pauling, descemos em período, e portanto, aumentamos o raio atômico.
Quando aumentamos o número de prótons, aumentamos a atração entre prótons e elétrons e portanto, diminuímos o raio atômico.
Portanto, o raio atômico segue este padrão:
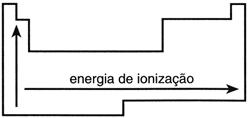
Outra propriedade periódica muito importante é o POTENCIAL OU ENERGIA DE IONIZAÇÃO!
Quando um átomo absorve energia, os elétrons podem ser transferidos de um nível para outro mais afastado do núcleo. Se a energia fornecida for suficientemente alta, será possível arrancar o elétron do átomo em questão, transformando-o em um íon positivo.
A energia de ionização é a energia mínima necessária para arrancar um elétron de um átomo que se encontra no estado fundamental e gasoso.
Em uma família, o potencial de ionização aumenta de baixo para cima a medida que o Z diminui. Isso ocorre pois quanto menos camadas temos, mais os elétrons estão próximos ao núcleo, assim aumenta também a atração exercida entre o núcleo e o elétron, acarretando em um maior potencial de ionização.
Portanto, o potencial de ionização segue este padrão:
A próxima propriedade periódica que vamos estudar será a AFINIDADE ELETRÔNICA!
Como vimos, é possível arrancar um eletron de um átomo, bastando para isso apenas fornecer um potencial de ionização.Vejamos uma situação inversa.
Seja um determinado átomo gasoso, isolado e no estado fundamental. Esse átomo pode receber 1 elétron externo, e nesse caso, haverá liberação de energia. Assim o átomo se transforma em um íon negativo.
A quantidade de energia liberada pelo átomo ao receber o elétron será tanto maior quanto mais fortemente o elétron atraído se ligar ao átomo.
Afinidade eletrônica ou eletroafinidade de um átomo é a quantidade de energia liberada quando um átomo gasoso isolado e no estado fundamental recebe 1 elétron.
Em uma família, a afinidade eletronica aumenta a medida que o numero atomico diminui. Isso ocorre pois quando maior for a atração exercida pelo atomo sobre o elétron a ser recebido na sua camada mais externa, tanto maior será a energia liberada. (AE).
Em um período: A afinidade eletrônica aumenta à medida que o Z aumenta, e isto ocorre da direita para a esquerda.
Como os átomos de um mesmo período possuem o mesmo número de camadas, o aumento da carga nuclear faz com que o raio atômico diminua e, consequentemente, aumente a atração exercida sobre o elétron a ser recebido, o que causa também um aumento na afinidade eletrônica.
Portanto, a Afinidade Eletrônica segue o seguinte padrão:

Os gases nobres não participam pois já tem 8 elétrons na última camada, não recebendo então elétrons!
ELETRONEGATIVIDADE
A eletronegatividade é a medida da capacidade de um átomo atrair elétrons de outros átomos.
Os gases nobres novamente não participam por já possuírem 8 elétrons na última camada e não ser necessário atrair outros elétrons.
Temos uma lista com os elementos mais eletronegativos
F-O-N-Cl-Br-I-S-C-P-H
(Fui ontem no Clube, Briguei com o Ivan, saí correndo pro Hospital). Assim fica fácil decorar né?
Lembrando que o elemento mais eletronegativo da nossa tabela é o Flúor!
Bom Alunos, tentem fazer os exercícios deste capítulo da apostila,
qualquer coisa, estou a disposição de vocês!
Meu email é ana.barboza@usp.br!
Até mais, Bons estudos!
Nenhum comentário:
Postar um comentário