Nomenclatura de Bases
A nomenclatura de bases é mais fácil e possui menos detalhes que a nomenclatura de ácidos.
As bases de Arrhenius são compostos iônicos formados por um cátion de elemento metálico ligado ionicamente ao íon OH-
Para conseguirmos determinar fórmula de uma base, precisamos saber COM CLAREZA, as cargas das substâncias.
Observe a figura abaixo:
Regra de Nomenclatura:
Para elementos com carga fixa:
Hidróxido de (elemento)
Se o elemento tiver mais de uma carga presente, temos que diferenciá-lo.
Existem dois modos, primeiro:
Hidróxido de (elemento) (carga em números romanos)
ou
quando tiver duas cargas presentes:
Hidróxido ...... ICO - para o de maior carga
Hidróxido .......OSO - para o de menor carga
Exemplos:
Carga Fixa : KOH - Hidróxido de Potássio
Mais de duas cargas: Mn(OH)2 - Hidróxio de Manganês II
Mn(OH)3 - Hidróxido de Manganês III
Mn(OH)4 - Hidróxido de Manganês IV
Para apenas duas cargas: Fe(OH)3 - Hidróxido férrico
Fe(OH)2 - Hidróxido ferroso
Qualquer dúvida, só procurar!
quinta-feira, 2 de agosto de 2012
Compostos Inorgânicos - PARTE 1
ÁCIDOS E BASES -
Os ácidos e bases são compostos inorgânicos, e de acordo com Arrhenius,
Ácido: Todo composto que, dissolvido em água, origina H+ como seu único cátion.
Base: Todo composto que dissolvido em água , origina OH- como seu único ânion.
Os ácidos muitas vezes possuem sabores azedos, e as bases, sabor adstringente(amarra a boca).
Existem importantes indicadores que no dia-a-dia podem definir se uma subtância é um ácido ou uma base. Os mais utilizados em laboratório são Fenolftaleína e Tornassol.
A Fenolftaleína deixa o meio ácido incolor e o meio básico rosa. Enquanto isso, o Tornassol deixa o meio ácido avermelhado e o meio básico azul.
Para Arrhenius, o motivo dos indicadores mudarem de cor, é que entram em contato com o H+ e com o OH-, que determinam estas substâncias.
Estas substâncias mostram diferentes processos quando colocados em água. As bases sofrem dissociação iônica, que ocorre quando os íons se separam quando uma substância iônica está em contato com a água.
Exemplo: KOH ===> K+ + OH-
Ca(OH)2 ====> Ca2+ + 2OH-
Já os ácidos, sofrem ionização, que é o processo em que íons são criados quando certas substâncias moleculares se dissolvem em água.
Ex: H2SO4 ===> 2H+ + SO4 2-
HBr ===> H+ + Br-
ÁCIDOS
Hidrácidos (Ácidos não oxigenados)
NOMENCLATURA
(Elemento) + ídrico
Exemplos:
HF - Ácido fluorídrico
HCl - Ácido clorídrico
Os ânions formados após a ionização destes ácidos terão a seguinte norma de NOMENCLATURA:
(Elemento) + eto
Exemplos:
HBr ===> H+ + Br-
O Br- recebe o nome de BromETO.
Oxiácidos (Ácidos oxigenados)
Há várias maneiras de dar nome para os ácidos que contém hidrogênio, a mais simples e pedida no vestibular será exposta logo abaixo.
Os que tiverem MAIS oxigênio, terão a terminação ICO
Os que tiverem MENOS oxigênio, terão a terminação OSO
Exemplos:
H2SO4 ===> QUATRO Oxigênios... É chamado de Ácido SulfúrICO
H2SO3 ===> TRÊS Oxigênios.. É chamado de Ácido SulfurOSO.
Porém, há casos em que existem MAIS de dois ácidos disponíveis de um determinado elemento, como é o caso do Cloro.
O cloro possui
HClO4
HClO3
HClO2
HClO
Como diferenciar o nome dos mesmos?
Resposta simples, utilizando dois importantes prefixos. PER e HIPO
Per é o utilizado para o que tem MAIS OXIGÊNIOS DE TODOS.. E HIPO para o que possui MENOS OXIGÊNIO que todos.
Observe
HClO4 ===> Ácido perclórico
HClO3===> Ácido clórico
HClO2 ===> Ácido cloroso
HClO ===> Ácido hipocloroso
Para dar nome aos ânions formados por estes ácidos, é simples...
O que era ICO , vira ATO .. Se tiver PER, carrega o per junto.
Se for OSO, viro ITO.. Se tiver Hipo, leva o hipo junto.
Exemplo:
HClO4 ===> Ácido perclórico ====> H+ + ClO4 - Perclorato
HClO3===> Ácido clórico ====> H+ + ClO3- Clorato
HClO2 ===> Ácido cloroso ====> H+ + ClO2- Clorito
HClO ===> Ácido hipocloroso ====> H+ + ClO- Hipoclorito
Até a próxima aula com Bases.
Os ácidos e bases são compostos inorgânicos, e de acordo com Arrhenius,
Ácido: Todo composto que, dissolvido em água, origina H+ como seu único cátion.
Base: Todo composto que dissolvido em água , origina OH- como seu único ânion.
Os ácidos muitas vezes possuem sabores azedos, e as bases, sabor adstringente(amarra a boca).
Existem importantes indicadores que no dia-a-dia podem definir se uma subtância é um ácido ou uma base. Os mais utilizados em laboratório são Fenolftaleína e Tornassol.
A Fenolftaleína deixa o meio ácido incolor e o meio básico rosa. Enquanto isso, o Tornassol deixa o meio ácido avermelhado e o meio básico azul.
Para Arrhenius, o motivo dos indicadores mudarem de cor, é que entram em contato com o H+ e com o OH-, que determinam estas substâncias.
Estas substâncias mostram diferentes processos quando colocados em água. As bases sofrem dissociação iônica, que ocorre quando os íons se separam quando uma substância iônica está em contato com a água.
Exemplo: KOH ===> K+ + OH-
Ca(OH)2 ====> Ca2+ + 2OH-
Já os ácidos, sofrem ionização, que é o processo em que íons são criados quando certas substâncias moleculares se dissolvem em água.
Ex: H2SO4 ===> 2H+ + SO4 2-
HBr ===> H+ + Br-
ÁCIDOS
Hidrácidos (Ácidos não oxigenados)
NOMENCLATURA
(Elemento) + ídrico
Exemplos:
HF - Ácido fluorídrico
HCl - Ácido clorídrico
Os ânions formados após a ionização destes ácidos terão a seguinte norma de NOMENCLATURA:
(Elemento) + eto
Exemplos:
HBr ===> H+ + Br-
O Br- recebe o nome de BromETO.
Oxiácidos (Ácidos oxigenados)
Há várias maneiras de dar nome para os ácidos que contém hidrogênio, a mais simples e pedida no vestibular será exposta logo abaixo.
Os que tiverem MAIS oxigênio, terão a terminação ICO
Os que tiverem MENOS oxigênio, terão a terminação OSO
Exemplos:
H2SO4 ===> QUATRO Oxigênios... É chamado de Ácido SulfúrICO
H2SO3 ===> TRÊS Oxigênios.. É chamado de Ácido SulfurOSO.
Porém, há casos em que existem MAIS de dois ácidos disponíveis de um determinado elemento, como é o caso do Cloro.
O cloro possui
HClO4
HClO3
HClO2
HClO
Como diferenciar o nome dos mesmos?
Resposta simples, utilizando dois importantes prefixos. PER e HIPO
Per é o utilizado para o que tem MAIS OXIGÊNIOS DE TODOS.. E HIPO para o que possui MENOS OXIGÊNIO que todos.
Observe
HClO4 ===> Ácido perclórico
HClO3===> Ácido clórico
HClO2 ===> Ácido cloroso
HClO ===> Ácido hipocloroso
Para dar nome aos ânions formados por estes ácidos, é simples...
O que era ICO , vira ATO .. Se tiver PER, carrega o per junto.
Se for OSO, viro ITO.. Se tiver Hipo, leva o hipo junto.
Exemplo:
HClO4 ===> Ácido perclórico ====> H+ + ClO4 - Perclorato
HClO3===> Ácido clórico ====> H+ + ClO3- Clorato
HClO2 ===> Ácido cloroso ====> H+ + ClO2- Clorito
HClO ===> Ácido hipocloroso ====> H+ + ClO- Hipoclorito
Até a próxima aula com Bases.
Forças intermoleculares - Parte 2 (Ponto de Ebulição)
Para que a gente consiga entender definitivamente esta matéria, falta compararmos como as forças intermoleculares que estudamos influenciam no PONTO DE EBULIÇÃO!
Os pontos de ebulição entre as moléculas alteram..
Quando fervemos uma substância, estamos, na verdade, rompendo estas ligações intermoleculares que determinam seus estados físicos da matéria em sólido e líquido.
Quanto mais FORTE forem as interações intermoleculares, MAIS unidas elas estarão, e portanto, MAIS DIFÍCIL será ferver e quebrar estas interações.
OU SEJA, A SUBSTÂNCIA QUE TIVER FORÇAS INTERMOLECULARES MAIS FORTES, TERÃO PONTO DE EBULIÇÃO MAIS ALTO!
Mas e quando as substâncias possuem A MESMA FORÇA INTERMOLECULAR? O QUE MUDA O PONTO DE EBULIÇÃO??!
Aí vem um outro fator, que é a MASSA DA MOLÉCULA..
Quanto maior a massa da molécula, mais difícil será fazer a molécula desprender de seu estado físico, portanto, maior temperatura é necessária para este desprendimento.
OU SEJA,
AO COMPARARMOS DUAS SUBSTÂNCIAS COM O MESMO TIPO DE FORÇA INTERMOLECULAR, A QUE TIVER MAIOR MASSA TERÁ O MAIOR PONTO DE EBULIÇÃO!
Qualquer dúvida, ana.barboza@usp.br
Obrigada!!!
Os pontos de ebulição entre as moléculas alteram..
Quando fervemos uma substância, estamos, na verdade, rompendo estas ligações intermoleculares que determinam seus estados físicos da matéria em sólido e líquido.
Quanto mais FORTE forem as interações intermoleculares, MAIS unidas elas estarão, e portanto, MAIS DIFÍCIL será ferver e quebrar estas interações.
OU SEJA, A SUBSTÂNCIA QUE TIVER FORÇAS INTERMOLECULARES MAIS FORTES, TERÃO PONTO DE EBULIÇÃO MAIS ALTO!
Mas e quando as substâncias possuem A MESMA FORÇA INTERMOLECULAR? O QUE MUDA O PONTO DE EBULIÇÃO??!
Aí vem um outro fator, que é a MASSA DA MOLÉCULA..
Quanto maior a massa da molécula, mais difícil será fazer a molécula desprender de seu estado físico, portanto, maior temperatura é necessária para este desprendimento.
OU SEJA,
AO COMPARARMOS DUAS SUBSTÂNCIAS COM O MESMO TIPO DE FORÇA INTERMOLECULAR, A QUE TIVER MAIOR MASSA TERÁ O MAIOR PONTO DE EBULIÇÃO!
Qualquer dúvida, ana.barboza@usp.br
Obrigada!!!
Forças intermoleculares - parte 1
Em uma das primeiras aulas do curso, comentamos sobre os diferentes estados físicos da matéria.
Vamos relembrar...
O sólido da matéria possui volume fixo e forma fixa.. A força atrativa entre as moléculas é forte, porém a energia cinética, ou seja, a energia do movimento, é baixo, porque as moléculas pouco se movimentam. O espaço entre as moléculas é pequeno...
Enquanto isso, o estado líquido, tem volume fixo, porém forma variada. O espaço entre as moléculas ainda é pequeno, porém maior que o estado sólido. Cada molecula está livre para se movimentar, porém sob influência das moléculas vizinhas, ou seja, a energia cinética entre as moléculas é intermediária.
Assim, por dedução, sabemos que o estado gasoso tem uma força atrativa entre as moléculas muitíssimo fraca, e possui movimento caótico entre as moléculas, ou seja, alta energia cinética...
Mas daí vem a pergunta...
QUE FORÇAS MANTÊM AS MOLÉCULAS UNIDAS NESTES ESTADOS FÍSICOS?
Daí temos as forças INTERmoleculares...
São três tipos:
1) DIPOLO-DIPOLO
2) PONTES DE HIDROGÊNIO
3) DIPOLO INSTANTÂNEO-DIPOLO INDUZIDO
1) DIPOLO-DIPOLO
As moleculas polares, como vimos na última postagem, têm grande diferença de eletronegatividade... Assim um lado fica positivo, e o outro, por sua vez, negativo, temporariamente.
O lado positivo, irá se ligar ao lado negativo de uma outra molécula, e por aí vai.
Ou seja, este tipo de interação ocorre, principalmente, em moléculas polares, e é ela a responsável por deixar estas substâncias agregadas em estados físicos como o sólido ou líquido.
Observe a imagem abaixo:
2) Interações do tipo PONTE DE HIDROGÊNIO
Quando em uma molécula, temos o hidrogênio ligado aos três elementos mais eletronegativos, por sua vez, Flúor(F), Oxigênio (O), Nitrogênio (N), haverá uma grande interação entre estes elementos, exatamente, pela grande diferença de eletronegatividade.
Isto faz com que os átomos interajam de forma extremamente forte, e esta interação é chamada de pontes de hidrogênio.
Na água, por exemplo, é este tipo de interação que mantém as moléculas unidas...
Observe abaixo a forma com que representamos, e a forma com que ocorre as pontes de hidrogênio:
3) Interações do tipo DIPOLO INSTANTÂNEO-DIPOLO INDUZIDO
As moléculas apolares possuem nuvens de elétrons em contínuo movimento. Elas não concentram os elétrons como ocorre nos demais casos, até porque não possuem grandes diferenças no vetor polaridade, e em alguns casos, os elementos presentes, se forem iguais, tem a mesma eletronegatividade.
Se em uma pequena fração de segundo, a nuvem eletrônica se deslocar para um lado, podemos dizer que foi criado um dipolo instantâneo. Isso também quer dizer que temporariamente, dois polos foram criados nesta molécula em questão...
A extremidade que ficou temporariamente positiva, atrairá moléculas temporariamente negativas.
Este fenômeno ocorre em todas as substâncias, mas tem significado principalmente nas moléculas apolares e são conhecidas também como Forças de dispersão de London.
Observe a imagem abaixo para entender melhor:
ASSIM,
podemos dizer que por ordem de força
as mais fortes são as pontes de hidrogênio, seguidas pelo dipolo-dipolo e, por último, a mais fraca dipolo instantâneo, dipolo induzido...
Ok?
Espero que tenham entendido.
Qualquer dúvida, só procurar.
Vamos relembrar...
O sólido da matéria possui volume fixo e forma fixa.. A força atrativa entre as moléculas é forte, porém a energia cinética, ou seja, a energia do movimento, é baixo, porque as moléculas pouco se movimentam. O espaço entre as moléculas é pequeno...
Enquanto isso, o estado líquido, tem volume fixo, porém forma variada. O espaço entre as moléculas ainda é pequeno, porém maior que o estado sólido. Cada molecula está livre para se movimentar, porém sob influência das moléculas vizinhas, ou seja, a energia cinética entre as moléculas é intermediária.
Assim, por dedução, sabemos que o estado gasoso tem uma força atrativa entre as moléculas muitíssimo fraca, e possui movimento caótico entre as moléculas, ou seja, alta energia cinética...
Mas daí vem a pergunta...
QUE FORÇAS MANTÊM AS MOLÉCULAS UNIDAS NESTES ESTADOS FÍSICOS?
Daí temos as forças INTERmoleculares...
São três tipos:
1) DIPOLO-DIPOLO
2) PONTES DE HIDROGÊNIO
3) DIPOLO INSTANTÂNEO-DIPOLO INDUZIDO
1) DIPOLO-DIPOLO
As moleculas polares, como vimos na última postagem, têm grande diferença de eletronegatividade... Assim um lado fica positivo, e o outro, por sua vez, negativo, temporariamente.
O lado positivo, irá se ligar ao lado negativo de uma outra molécula, e por aí vai.
Ou seja, este tipo de interação ocorre, principalmente, em moléculas polares, e é ela a responsável por deixar estas substâncias agregadas em estados físicos como o sólido ou líquido.
Observe a imagem abaixo:
2) Interações do tipo PONTE DE HIDROGÊNIO
Quando em uma molécula, temos o hidrogênio ligado aos três elementos mais eletronegativos, por sua vez, Flúor(F), Oxigênio (O), Nitrogênio (N), haverá uma grande interação entre estes elementos, exatamente, pela grande diferença de eletronegatividade.
Isto faz com que os átomos interajam de forma extremamente forte, e esta interação é chamada de pontes de hidrogênio.
Na água, por exemplo, é este tipo de interação que mantém as moléculas unidas...
Observe abaixo a forma com que representamos, e a forma com que ocorre as pontes de hidrogênio:
3) Interações do tipo DIPOLO INSTANTÂNEO-DIPOLO INDUZIDO
As moléculas apolares possuem nuvens de elétrons em contínuo movimento. Elas não concentram os elétrons como ocorre nos demais casos, até porque não possuem grandes diferenças no vetor polaridade, e em alguns casos, os elementos presentes, se forem iguais, tem a mesma eletronegatividade.
Se em uma pequena fração de segundo, a nuvem eletrônica se deslocar para um lado, podemos dizer que foi criado um dipolo instantâneo. Isso também quer dizer que temporariamente, dois polos foram criados nesta molécula em questão...
A extremidade que ficou temporariamente positiva, atrairá moléculas temporariamente negativas.
Este fenômeno ocorre em todas as substâncias, mas tem significado principalmente nas moléculas apolares e são conhecidas também como Forças de dispersão de London.
Observe a imagem abaixo para entender melhor:
ASSIM,
podemos dizer que por ordem de força
as mais fortes são as pontes de hidrogênio, seguidas pelo dipolo-dipolo e, por último, a mais fraca dipolo instantâneo, dipolo induzido...
Ok?
Espero que tenham entendido.
Qualquer dúvida, só procurar.
segunda-feira, 23 de julho de 2012
Polaridade
Bom dia alunos, como estão indo de férias?
Espero que estejam bem e que tenham aproveitado para descansar sem desenferrujar.
O tema de hoje á a polaridade de ligações químicas.
O primeiro passo para avaliarmos a polaridade de uma ligação química é desenhar a molécular de acordo com as regrinhas de ligações covalentes, e posteriormente, já determinar sua geometria e desenhar a molécula na geometria em questão.
Logo após isso, iremos avaliar, de cada elemento que constitui esta molécula, sua respectiva Eletronegatividade.
Vocês se lembram o que é Eletronegatividade? Caso não se lembrem, a Eletronegatividade é uma propriedade periódica que diz muito sobre a capacidade de um átomo de atrair um elétron de um outro átomo. Se ele acaba atraindo um elétron de um outro átomo, e sabendo que o elétron nada mais é que uma carga negativa, TEMPORARIAMENTE, o átomo em questão estará negativo (por estar com este elétron sobrando). Enquanto isso, o outro átomo que TEMPORARIAMENTE perdeu seu elétron, vai estar com um próton sobrando, ficando assim positivo.
Observe:
Este símbolo ao lado do menos ou do mais na foto indica o sentido de "temporariamente" que conhecemos.
Logo após isto, devemos desenhar os vetores. Os vetores vão no mesmo sentido que os elétrons, ou seja, do MAIS para o MENOS.
Assim, para descobrir a POLARIDADE, se a soma dos vetores for IGUAL a zero, a molécula é APOLAR.
Se a soma dos vetores for DIFERENTE de zero, a molécula é POLAR.
Observe a mesma imagem com os vetores:
Espero que estejam bem e que tenham aproveitado para descansar sem desenferrujar.
O tema de hoje á a polaridade de ligações químicas.
O primeiro passo para avaliarmos a polaridade de uma ligação química é desenhar a molécular de acordo com as regrinhas de ligações covalentes, e posteriormente, já determinar sua geometria e desenhar a molécula na geometria em questão.
Logo após isso, iremos avaliar, de cada elemento que constitui esta molécula, sua respectiva Eletronegatividade.
Vocês se lembram o que é Eletronegatividade? Caso não se lembrem, a Eletronegatividade é uma propriedade periódica que diz muito sobre a capacidade de um átomo de atrair um elétron de um outro átomo. Se ele acaba atraindo um elétron de um outro átomo, e sabendo que o elétron nada mais é que uma carga negativa, TEMPORARIAMENTE, o átomo em questão estará negativo (por estar com este elétron sobrando). Enquanto isso, o outro átomo que TEMPORARIAMENTE perdeu seu elétron, vai estar com um próton sobrando, ficando assim positivo.
Observe:
Este símbolo ao lado do menos ou do mais na foto indica o sentido de "temporariamente" que conhecemos.
Logo após isto, devemos desenhar os vetores. Os vetores vão no mesmo sentido que os elétrons, ou seja, do MAIS para o MENOS.
Assim, para descobrir a POLARIDADE, se a soma dos vetores for IGUAL a zero, a molécula é APOLAR.
Se a soma dos vetores for DIFERENTE de zero, a molécula é POLAR.
Observe a mesma imagem com os vetores:
É isso, qualquer dúvida, vocês sabem onde me procurar.
Ana
Ana
quarta-feira, 30 de maio de 2012
Programa Didático para visualização de moléculas em 3D
Para visualizarmos a GEOMETRIA MOLECULAR é muito interessante conseguirmos imaginar a molécula em 3D.
Na aula que vem, iremos explorar um programa para computadores que nos permite visualizar e montar moléculas de forma fácil e interessante.
Aqui segue o link:
http://chemsketch.softonic.com.br/
Façam o download e tentem brincar. Semana que vem iremos aprender ainda mais sobre este programa.
Bons estudos!
Na aula que vem, iremos explorar um programa para computadores que nos permite visualizar e montar moléculas de forma fácil e interessante.
Aqui segue o link:
http://chemsketch.softonic.com.br/
Façam o download e tentem brincar. Semana que vem iremos aprender ainda mais sobre este programa.
Bons estudos!
Geometria Molecular
A geometria molecular nos mostra com qual formato as moléculas ficam após realizarem suas ligações. Para analisá-la, devemos fazer a ligação covalente e perceber se existe sobra de elétrons, ou seja, formação de nuvens de elétrons.
Observe:
Observe:
Assim, nós utilizamos o roteiro abaixo para determinar a geometria das moléculas, observe:
Bons estudos!
Prof. Ana
Prof. Ana
Ligações Metálicas - Propriedades, modelo e características
A ligação metálica, como o nome já diz, ocorre entre metais. Isto é, elementos com alta eletropositividade.
Teoria do mar de elétrons:
Os metais possuem grande tendência em perder elétrons. De acordo com esta teoria, alguns átomos do metal perdem elétrons em suas últimas camadas. Estes elétrons ficam "passeando" entre os átomos dos metais, e são estes elétrons que mantém os metais unidos, pois existe uma força de atração entre estes elétrons livres que ficam entre cátions.
Propriedades dos Metais:
- Alta condutibilidade elétrica
- Alta condutibilidade térmica
- Alta maleabilidade (capacidade de transformar em Lâminas)
- Brilho Metálico
- Pontos de fusão e ebulição elevados
- Ductibilidade (capacidade em se transformar em fios)
- Resistência à tração e choques mecânicos.
Ligas Metálicas:
As ligas metálicas são assim utilizadas para alterar e melhorar características do metal puro, como dureza, alterações no ponto de ebulição que pode ficar maior ou menor, aumento de resistência mecânica, dentre outras.
As principais ligas metálicas são:
Aço - Fe + C
Latão - Cu + Zn
Bronze - Cu + Sn
Aço inoxidável - Fe + C + Cu+ Ni
Ouro para jóias - Ag + Au + Cu
sexta-feira, 4 de maio de 2012
Ligações Covalentes Dativas
Bom dia alunos!
Não se esqueçam de entregar a lista semana que vem!
Testem-se , verifiquem onde estão as dúvidas, e na próxima semana, já estou providenciando outra lista também!
Bom, para entendermos as ligações dativas, vamos analisar a molécula de OZÔNIO , O3.
É neste instante que entram as ligações covalentes dativas. Quando, no meio da resolução de uma ligação, você percebe que mesmo existindo um átomo satisfeito ainda se faz necessário realizar ligações!
Observe como a dativa atua:
A representação da ligação covalente dativa é uma seta, assim na fórmula final temos:
Não se esqueçam de entregar a lista semana que vem!
Testem-se , verifiquem onde estão as dúvidas, e na próxima semana, já estou providenciando outra lista também!
Bom, para entendermos as ligações dativas, vamos analisar a molécula de OZÔNIO , O3.
Observe como a dativa atua:
A representação da ligação covalente dativa é uma seta, assim na fórmula final temos:
Para treinar o raciocínio que se deve ter em DATIVAS, façam exercícios! Treinem os que fizemos em sala!
Bons estudos!
Prof. Ana
ana.barboza@usp.brquarta-feira, 2 de maio de 2012
Ligações Covalentes Simples
Boa noite alunos!
Como andam os estudos?
Espero que estejam tranquilos com a matéria. Qualquer dúvida, sabem que é só me procurar.
A postagem de hoje do blog irá abordar um tema muito importante na Química Geral : As ligações covalentes!
Primeiramente, devemos saber reconhecer uma ligação covalente, e isto se torna tranquilo quando sabemos que elas ocorrem principalmente entre ametais, e entre ametais + H.
Além disso, convém ressaltar que os ametais tem grande tendência em RECEBER elétrons, como vimos na aula do Diagrama de Pauling, ou seja, para eles se torna praticamente impossível, ligando-se entre si, que eles transfiram elétrons, assim, eles apenas compartilham. Ou seja, se um elemento está precisando de um elétron e o outro também, eles compartilham 1 elétron, assim, no final, nenhum deles precisará de nenhum. (É este raciocínio que devemos ter para entendermos as ligações covalentes).
As ligações covalentes são dividas em simples e dativas. As que iremos ver agora são as ligações simples (as dativas ficarão para a próxima postagem). As ligações simples ocorrem quando o número de ligações que o elemento pode fornecer é suficiente para saciar a ligação.
Elas são divididas principalmente em:
Ligação simples : quando é necessário se realizar apenas uma ligação..
O símbolo é apenas um traço. Exemplo : H-O-H
Ligação Dupla: quando é necessário realizar duas ligações para saciar os átomos ligantes.
O símbolo é um traço DUPLO : Exemplo O=C=O
Ligação Tripla : quando é necessário realizar três ligações para saciar os átomos ligantes.
Exemplo:
Para montarmos moléculas ligadas covalentemente, é interessante que percebamos algumas tendências:
1) Simetria
Normalmente as moléculas covalentes seguem o princípio da simetria.
Para escolhermos o átomo central, verificamos aquele que tem o maior número de ligações disponíveis.
Por exemplo, na molécula de água (H20), o hidrogênio é capaz de fazer uma ligação e o oxigênio duas. Então o oxigênio tem mais capacidade de ser o átomo central, neste caso, pois ele teria capacidade de agregar em si o maior número de átomos!
Além disso, para seguirmos a simetria, neste exemplo, temos DOIS hidrogênios e um Oxigênio. Para ficar simétrico, o sensato é deixar um hidrogênio de cada lado, e o oxigênio ao centro.
Nem sempre ocorre a simetria total, mas pensar o jeito mais simétrico possível auxilia a montar a molécula.
Observe alguns exemplos:
Boa sorte e até a próxima postagem com Ligações Covalentes Dativas.
Como andam os estudos?
Espero que estejam tranquilos com a matéria. Qualquer dúvida, sabem que é só me procurar.
A postagem de hoje do blog irá abordar um tema muito importante na Química Geral : As ligações covalentes!
Primeiramente, devemos saber reconhecer uma ligação covalente, e isto se torna tranquilo quando sabemos que elas ocorrem principalmente entre ametais, e entre ametais + H.
Além disso, convém ressaltar que os ametais tem grande tendência em RECEBER elétrons, como vimos na aula do Diagrama de Pauling, ou seja, para eles se torna praticamente impossível, ligando-se entre si, que eles transfiram elétrons, assim, eles apenas compartilham. Ou seja, se um elemento está precisando de um elétron e o outro também, eles compartilham 1 elétron, assim, no final, nenhum deles precisará de nenhum. (É este raciocínio que devemos ter para entendermos as ligações covalentes).
As ligações covalentes são dividas em simples e dativas. As que iremos ver agora são as ligações simples (as dativas ficarão para a próxima postagem). As ligações simples ocorrem quando o número de ligações que o elemento pode fornecer é suficiente para saciar a ligação.
Elas são divididas principalmente em:
Ligação simples : quando é necessário se realizar apenas uma ligação..
O símbolo é apenas um traço. Exemplo : H-O-H
Ligação Dupla: quando é necessário realizar duas ligações para saciar os átomos ligantes.
O símbolo é um traço DUPLO : Exemplo O=C=O
Ligação Tripla : quando é necessário realizar três ligações para saciar os átomos ligantes.
Exemplo:
Para montarmos moléculas ligadas covalentemente, é interessante que percebamos algumas tendências:
1) Simetria
Normalmente as moléculas covalentes seguem o princípio da simetria.
Para escolhermos o átomo central, verificamos aquele que tem o maior número de ligações disponíveis.
Por exemplo, na molécula de água (H20), o hidrogênio é capaz de fazer uma ligação e o oxigênio duas. Então o oxigênio tem mais capacidade de ser o átomo central, neste caso, pois ele teria capacidade de agregar em si o maior número de átomos!
Além disso, para seguirmos a simetria, neste exemplo, temos DOIS hidrogênios e um Oxigênio. Para ficar simétrico, o sensato é deixar um hidrogênio de cada lado, e o oxigênio ao centro.
Nem sempre ocorre a simetria total, mas pensar o jeito mais simétrico possível auxilia a montar a molécula.
Observe alguns exemplos:
Se você ainda tiver dúvidas sobre quantas ligações cada elemento realiza, guarde isto no coração:
2) Hidrogênio liga em Oxigênio (quando houver...)
Em casos de moléculas em que possuam estes dois elementos, normalmente a tendência é o Hidrogênio ligar em Oxigênio...
3) Oxigênio liga no átomo central (quando houver...)
Quando o oxigênio não é o átomo central, e temos na molécula Oxigênio e Hidrogênio, normalmente, esta regra é seguida.
Vale lembrar que para ficarmos eficazes em realizar ligações covalentes, é necessário treino. Resolva os exercícios da apostila complementares, e busque seguir estas recomendações.
Verifique os exercícios que realizamos em aula e aplique ainda mais!
Boa sorte e até a próxima postagem com Ligações Covalentes Dativas.
Ana Beatriz Fernandes Barboza
ana.barboza@usp.br
sexta-feira, 20 de abril de 2012
Ligações iônicas
Bom dia alunos,
Que tal revisarmos um pouco sobre como funcionam, para que servem e em que casos ocorrem as ligações iônicas!
Primeiramente, devemos lembrar que a ligação iônica ocorre entre METAIS (Ex: Na+, Ca 2+, Mg 2+ dentre outros...) e AMETAIS (Ex: Cl - , F -, O 2-, S 2-), na maioria dos casos.
Se pensarmos quimicamente, percebemos que os metais normalmente possuem até 3 elétrons em sua camada de valência.
Isso quer dizer, que para atingir a regra do octeto, para os mesmos, é mais fácil perder até estes 3 elétrons, do que adquirir até 5 elétrons, ou seja, OS METAIS POSSUEM TENDÊNCIA EM PERDER ELÉTRONS!
Na mesma linha de pensamento, vamos analisar os AMETAIS. Os ametais possuem em geral entre 5 a 7 elétrons na última camada. Para eles, é mais fácil adquirir 3, 2 ou 1 elétron, do que perder todos os, no minimo, 5 elétrons que possuem na Camada de Valência. Assim, podemos concluir que os AMETAIS POSSUEM TENDÊNCIA EM GANHAR ELÉTRONS!
Observe o caso de um METAL como o Sódio:
Enquanto isto, quando um elemento PERDE um elétron, ele toma sinal POSITIVO. Assim, o Na, terá carga Na+.
Na ligação iônica, o sinal dos elementos ligantes deve ser invertido. Isso ocorre, pois neste tipo de ligaçõ ocorre TRANSFERÊNCIA DE ELÉTRONS, ou seja, o elemento que precisa PERDER um elétron CEDE o elétron para aquele que precisa GANHAR um elétron.
Ou seja, existe a transferência total dos elétrons!
MAS PROFESSORA, como fica a fórmula molecular das substâncias iônicas?!
Existem duas regras básicas e práticas para o vestibular!
1) Se os dois elementos ligantes tiverem o mesmo número de carga (Exemplo: Na+ e Cl -; K+ e F-, etc...)
Apenas ligue os dois elementos.
Ex: NaCl, e KF...
2) O CÁTION(íon positivo) DEVE ESTAR SEMPRE NA FRENTE DA FÓRMULA MOLECULAR
3) Caso não estejam em MESMO número de carga, utilize a REGRA DA PORTEIRA...
Observe exemplo:
Que tal revisarmos um pouco sobre como funcionam, para que servem e em que casos ocorrem as ligações iônicas!
Primeiramente, devemos lembrar que a ligação iônica ocorre entre METAIS (Ex: Na+, Ca 2+, Mg 2+ dentre outros...) e AMETAIS (Ex: Cl - , F -, O 2-, S 2-), na maioria dos casos.
Se pensarmos quimicamente, percebemos que os metais normalmente possuem até 3 elétrons em sua camada de valência.
Isso quer dizer, que para atingir a regra do octeto, para os mesmos, é mais fácil perder até estes 3 elétrons, do que adquirir até 5 elétrons, ou seja, OS METAIS POSSUEM TENDÊNCIA EM PERDER ELÉTRONS!
Na mesma linha de pensamento, vamos analisar os AMETAIS. Os ametais possuem em geral entre 5 a 7 elétrons na última camada. Para eles, é mais fácil adquirir 3, 2 ou 1 elétron, do que perder todos os, no minimo, 5 elétrons que possuem na Camada de Valência. Assim, podemos concluir que os AMETAIS POSSUEM TENDÊNCIA EM GANHAR ELÉTRONS!
Observe o caso de um METAL como o Sódio:
Figura 1. Diagrama de Linus Pauling do Elemento Sódio
Agora, observem o caso de um AMETAL como o Cloro:
Figura 2. Diagrama de Linus Pauling do Elemento Cloro
Neste contexto, sabemos que em química GANHAR na verdade é perder. Se um elemento GANHA um elétron, como é o caso do Cloro, seu sinal fica NEGATIVO, sendo Cl -
Enquanto isto, quando um elemento PERDE um elétron, ele toma sinal POSITIVO. Assim, o Na, terá carga Na+.
Na ligação iônica, o sinal dos elementos ligantes deve ser invertido. Isso ocorre, pois neste tipo de ligaçõ ocorre TRANSFERÊNCIA DE ELÉTRONS, ou seja, o elemento que precisa PERDER um elétron CEDE o elétron para aquele que precisa GANHAR um elétron.
Ou seja, existe a transferência total dos elétrons!
MAS PROFESSORA, como fica a fórmula molecular das substâncias iônicas?!
Existem duas regras básicas e práticas para o vestibular!
1) Se os dois elementos ligantes tiverem o mesmo número de carga (Exemplo: Na+ e Cl -; K+ e F-, etc...)
Apenas ligue os dois elementos.
Ex: NaCl, e KF...
2) O CÁTION(íon positivo) DEVE ESTAR SEMPRE NA FRENTE DA FÓRMULA MOLECULAR
3) Caso não estejam em MESMO número de carga, utilize a REGRA DA PORTEIRA...
Observe exemplo:
Bom gente, esta é a aula de Ligações Iônicas.. Gostaria que se houvesse alguma dúvida, vocês me procurassem. Este tema é essencial para entendermos os próximos temas que vêm por aí!
Bons estudos!
Bons estudos!
segunda-feira, 16 de abril de 2012
Propriedades Periódicas
Olá Alunos, Boa Tarde!
Primeiramente queria me desculpar com vocês com o tempinho que fiquei sem postar aqui.
Estava com uma certa sobrecarga de trabalho, mas esta semana irei postar tudo que está faltando para vocês.
O tema de hoje é: Propriedades Periódicas.
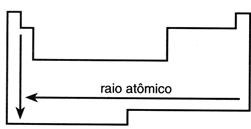
A primeira propriedade periódica que vamos estudar é o RAIO ATÔMICO!
Para que seja possível discutir a propriedade periódica do raio atômico, vamos considerar o átomo uma esfera, portanto o raio atômico será a distância do núcleo até o eletron mais externo.
Quando aumentamos o número de camadas do diagrama de Pauling, descemos em período, e portanto, aumentamos o raio atômico.
Quando aumentamos o número de prótons, aumentamos a atração entre prótons e elétrons e portanto, diminuímos o raio atômico.
Portanto, o raio atômico segue este padrão:
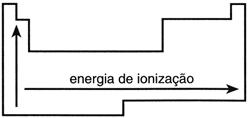
Outra propriedade periódica muito importante é o POTENCIAL OU ENERGIA DE IONIZAÇÃO!
Quando um átomo absorve energia, os elétrons podem ser transferidos de um nível para outro mais afastado do núcleo. Se a energia fornecida for suficientemente alta, será possível arrancar o elétron do átomo em questão, transformando-o em um íon positivo.
A energia de ionização é a energia mínima necessária para arrancar um elétron de um átomo que se encontra no estado fundamental e gasoso.
Em uma família, o potencial de ionização aumenta de baixo para cima a medida que o Z diminui. Isso ocorre pois quanto menos camadas temos, mais os elétrons estão próximos ao núcleo, assim aumenta também a atração exercida entre o núcleo e o elétron, acarretando em um maior potencial de ionização.
Portanto, o potencial de ionização segue este padrão:
A próxima propriedade periódica que vamos estudar será a AFINIDADE ELETRÔNICA!
Como vimos, é possível arrancar um eletron de um átomo, bastando para isso apenas fornecer um potencial de ionização.Vejamos uma situação inversa.
Seja um determinado átomo gasoso, isolado e no estado fundamental. Esse átomo pode receber 1 elétron externo, e nesse caso, haverá liberação de energia. Assim o átomo se transforma em um íon negativo.
A quantidade de energia liberada pelo átomo ao receber o elétron será tanto maior quanto mais fortemente o elétron atraído se ligar ao átomo.
Afinidade eletrônica ou eletroafinidade de um átomo é a quantidade de energia liberada quando um átomo gasoso isolado e no estado fundamental recebe 1 elétron.
Em uma família, a afinidade eletronica aumenta a medida que o numero atomico diminui. Isso ocorre pois quando maior for a atração exercida pelo atomo sobre o elétron a ser recebido na sua camada mais externa, tanto maior será a energia liberada. (AE).
Em um período: A afinidade eletrônica aumenta à medida que o Z aumenta, e isto ocorre da direita para a esquerda.
Como os átomos de um mesmo período possuem o mesmo número de camadas, o aumento da carga nuclear faz com que o raio atômico diminua e, consequentemente, aumente a atração exercida sobre o elétron a ser recebido, o que causa também um aumento na afinidade eletrônica.
Portanto, a Afinidade Eletrônica segue o seguinte padrão:

Os gases nobres não participam pois já tem 8 elétrons na última camada, não recebendo então elétrons!
ELETRONEGATIVIDADE
A eletronegatividade é a medida da capacidade de um átomo atrair elétrons de outros átomos.
Os gases nobres novamente não participam por já possuírem 8 elétrons na última camada e não ser necessário atrair outros elétrons.
Temos uma lista com os elementos mais eletronegativos
F-O-N-Cl-Br-I-S-C-P-H
(Fui ontem no Clube, Briguei com o Ivan, saí correndo pro Hospital). Assim fica fácil decorar né?
Lembrando que o elemento mais eletronegativo da nossa tabela é o Flúor!
Bom Alunos, tentem fazer os exercícios deste capítulo da apostila,
qualquer coisa, estou a disposição de vocês!
Meu email é ana.barboza@usp.br!
Até mais, Bons estudos!
Primeiramente queria me desculpar com vocês com o tempinho que fiquei sem postar aqui.
Estava com uma certa sobrecarga de trabalho, mas esta semana irei postar tudo que está faltando para vocês.
O tema de hoje é: Propriedades Periódicas.
A primeira propriedade periódica que vamos estudar é o RAIO ATÔMICO!
Para que seja possível discutir a propriedade periódica do raio atômico, vamos considerar o átomo uma esfera, portanto o raio atômico será a distância do núcleo até o eletron mais externo.
Quando aumentamos o número de camadas do diagrama de Pauling, descemos em período, e portanto, aumentamos o raio atômico.
Quando aumentamos o número de prótons, aumentamos a atração entre prótons e elétrons e portanto, diminuímos o raio atômico.
Portanto, o raio atômico segue este padrão:

Outra propriedade periódica muito importante é o POTENCIAL OU ENERGIA DE IONIZAÇÃO!
Quando um átomo absorve energia, os elétrons podem ser transferidos de um nível para outro mais afastado do núcleo. Se a energia fornecida for suficientemente alta, será possível arrancar o elétron do átomo em questão, transformando-o em um íon positivo.
A energia de ionização é a energia mínima necessária para arrancar um elétron de um átomo que se encontra no estado fundamental e gasoso.
Em uma família, o potencial de ionização aumenta de baixo para cima a medida que o Z diminui. Isso ocorre pois quanto menos camadas temos, mais os elétrons estão próximos ao núcleo, assim aumenta também a atração exercida entre o núcleo e o elétron, acarretando em um maior potencial de ionização.
Portanto, o potencial de ionização segue este padrão:

A próxima propriedade periódica que vamos estudar será a AFINIDADE ELETRÔNICA!
Como vimos, é possível arrancar um eletron de um átomo, bastando para isso apenas fornecer um potencial de ionização.Vejamos uma situação inversa.
Seja um determinado átomo gasoso, isolado e no estado fundamental. Esse átomo pode receber 1 elétron externo, e nesse caso, haverá liberação de energia. Assim o átomo se transforma em um íon negativo.
A quantidade de energia liberada pelo átomo ao receber o elétron será tanto maior quanto mais fortemente o elétron atraído se ligar ao átomo.
Afinidade eletrônica ou eletroafinidade de um átomo é a quantidade de energia liberada quando um átomo gasoso isolado e no estado fundamental recebe 1 elétron.
Em uma família, a afinidade eletronica aumenta a medida que o numero atomico diminui. Isso ocorre pois quando maior for a atração exercida pelo atomo sobre o elétron a ser recebido na sua camada mais externa, tanto maior será a energia liberada. (AE).
Em um período: A afinidade eletrônica aumenta à medida que o Z aumenta, e isto ocorre da direita para a esquerda.
Como os átomos de um mesmo período possuem o mesmo número de camadas, o aumento da carga nuclear faz com que o raio atômico diminua e, consequentemente, aumente a atração exercida sobre o elétron a ser recebido, o que causa também um aumento na afinidade eletrônica.
Portanto, a Afinidade Eletrônica segue o seguinte padrão:

Os gases nobres não participam pois já tem 8 elétrons na última camada, não recebendo então elétrons!
ELETRONEGATIVIDADE
A eletronegatividade é a medida da capacidade de um átomo atrair elétrons de outros átomos.
Os gases nobres novamente não participam por já possuírem 8 elétrons na última camada e não ser necessário atrair outros elétrons.
Temos uma lista com os elementos mais eletronegativos
F-O-N-Cl-Br-I-S-C-P-H
(Fui ontem no Clube, Briguei com o Ivan, saí correndo pro Hospital). Assim fica fácil decorar né?
Lembrando que o elemento mais eletronegativo da nossa tabela é o Flúor!
Bom Alunos, tentem fazer os exercícios deste capítulo da apostila,
qualquer coisa, estou a disposição de vocês!
Meu email é ana.barboza@usp.br!
Até mais, Bons estudos!
segunda-feira, 12 de março de 2012
Aulas 5 e 6
Bom dia queridos alunos!
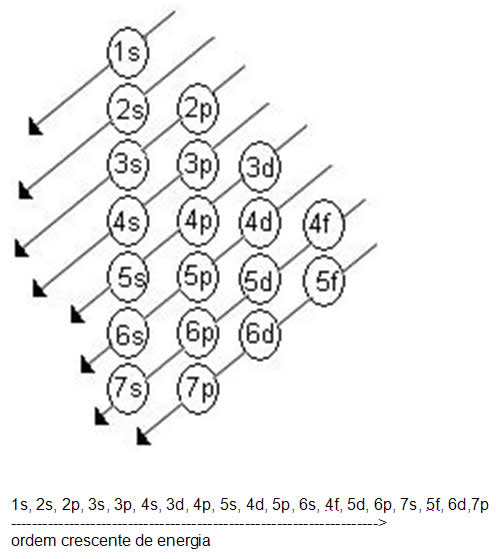
O tema da última aula,em geral, foi como distribuir os elétrons em subníveis de energia!
A forma com que fazemos isto é através do Diagrama de Pauling!
Não esqueçam de seguir as setas para realizar esta distruibuição!
Cada subnível comporta um determinado número de eletróns:
S: 2elétrons
P: 6 elétrons
D: 10 elétrons
F: 14 elétrons
Exemplo: Ca- Número Atômico =20
1s2
2s2 2p6
3s2 3p6
4s2
Não esqueçam também que nem sempre os elementos estão NEUTROS. Ou seja, nem sempre o número atômico, ou seja , o número de prótons, corresponde em igual ao número de elétrons!
Assim, quando eles não estiverem neutros...
Exemplo: Ca2+
No caso deste exemplo, o Cálcio está PERDENDO 2 elétrons.. (Na química, o símbolo de MAIS significa perder. E o símbolo de MENOS significa GANHAR).
Então, como ele está PERDENDO dois elétrons, nós devemos retirar os dois últimos elétrons da Camada de Valência
1s2
2s2 2p6
3s2 3p6
4s2
Então, o diagrama final do Ca2+ é:
1s2
2s2 2p6
3s2 3p6
E o contrário ocorrerá com elementos, a exemplo do Cl.
O Cloro tem número atômico igual a 17.
Então o diagrama seria:
1s2
2s2 2p6
3s2 3p5
Porém, na natureza, a tendência do Cloro é estar no estado Cl-.
Ou seja, ganhando um elétron!
Assim,no diagrama, devemos ADICIONAR um elétron a camada de valencia..
1s2
2s2 2p6
3s2 3p5 (+1)
Então, o resultado final é:
1s2
2s2 2p6
3s2 3p6
Precisamos lembrar também de dois conceitos que são muito utilizados quando falamos sobre Diagrama de Pauling.
Um dele é SUBNÍVEL MAIS ENERGÉTICO!
O subnível mais energético do Diagrama de Pauling é aquele em que se adicionou elétrons por último!
No Caso do Cl ,
1s2
2s2 2p6
3s2 3p5
O último subnível em que adicionamos elétrons é o 3p5, portanto este é o subnível mais energético!
No caso do Ca,
1s2
2s2 2p6
3s2 3p6
4s2
O subnível mais energético é o 4s2.
Outro conceito importante, é o conceito de CAMADA DE VALÊNCIA!
A camada de valência é a ultima camada em que aparece quando realizamos a distribuição eletrônica!
Observe os exemplos:
No caso do Cl
1s2
2s2 2p6
3s2 3p5
A camada de valência será 3s2 3p5.
No caso do Ca
1s2
2s2 2p6
3s2 3p6
4s2
A camada de valência será o 4s2 !
Bom, alunos, a matéria foi esta!
Estudem, realizem os exercícios complementares, e qualquer dúvida, me perguntem ou postem aqui.. Ou até mesmo me enviem um email em ana.barboza@usp.br.
Obrigada!
Prof. Ana
O tema da última aula,em geral, foi como distribuir os elétrons em subníveis de energia!
A forma com que fazemos isto é através do Diagrama de Pauling!
Não esqueçam de seguir as setas para realizar esta distruibuição!
Cada subnível comporta um determinado número de eletróns:
S: 2elétrons
P: 6 elétrons
D: 10 elétrons
F: 14 elétrons
Exemplo: Ca- Número Atômico =20
1s2
2s2 2p6
3s2 3p6
4s2
Não esqueçam também que nem sempre os elementos estão NEUTROS. Ou seja, nem sempre o número atômico, ou seja , o número de prótons, corresponde em igual ao número de elétrons!
Assim, quando eles não estiverem neutros...
Exemplo: Ca2+
No caso deste exemplo, o Cálcio está PERDENDO 2 elétrons.. (Na química, o símbolo de MAIS significa perder. E o símbolo de MENOS significa GANHAR).
Então, como ele está PERDENDO dois elétrons, nós devemos retirar os dois últimos elétrons da Camada de Valência
1s2
2s2 2p6
3s2 3p6
Então, o diagrama final do Ca2+ é:
1s2
2s2 2p6
3s2 3p6
E o contrário ocorrerá com elementos, a exemplo do Cl.
O Cloro tem número atômico igual a 17.
Então o diagrama seria:
1s2
2s2 2p6
3s2 3p5
Porém, na natureza, a tendência do Cloro é estar no estado Cl-.
Ou seja, ganhando um elétron!
Assim,no diagrama, devemos ADICIONAR um elétron a camada de valencia..
1s2
2s2 2p6
3s2 3p5 (+1)
Então, o resultado final é:
1s2
2s2 2p6
3s2 3p6
Precisamos lembrar também de dois conceitos que são muito utilizados quando falamos sobre Diagrama de Pauling.
Um dele é SUBNÍVEL MAIS ENERGÉTICO!
O subnível mais energético do Diagrama de Pauling é aquele em que se adicionou elétrons por último!
No Caso do Cl ,
1s2
2s2 2p6
3s2 3p5
O último subnível em que adicionamos elétrons é o 3p5, portanto este é o subnível mais energético!
No caso do Ca,
1s2
2s2 2p6
3s2 3p6
4s2
O subnível mais energético é o 4s2.
Outro conceito importante, é o conceito de CAMADA DE VALÊNCIA!
A camada de valência é a ultima camada em que aparece quando realizamos a distribuição eletrônica!
Observe os exemplos:
No caso do Cl
1s2
2s2 2p6
3s2 3p5
A camada de valência será 3s2 3p5.
No caso do Ca
1s2
2s2 2p6
3s2 3p6
4s2
A camada de valência será o 4s2 !
Bom, alunos, a matéria foi esta!
Estudem, realizem os exercícios complementares, e qualquer dúvida, me perguntem ou postem aqui.. Ou até mesmo me enviem um email em ana.barboza@usp.br.
Obrigada!
Prof. Ana
terça-feira, 6 de março de 2012
Aulas 3 e 4 - Modelos Atômicos
Bom dia alunos !!!
Na última aula conversamos bastante sobre os modelos atômicos que tivemos antes de chegar no átomo que conhecemos hoje!
A primeira forma em explicar o que seria o que hoje conhecemos como átomo surgiu na Grécia por Leucipo e Demócrito. Nesta época poucos acreditavam que os átomos de fato existiam, porém Leucipo e Demócrito mostravam já uma idéia primitiva de que os átomos existiam. Eles diziam que os materiais encontrados na natureza eram formados por partículas muito pequenas,invisíveis e indivisíveis!
Este modelo durou tempo considerável até que em 1808, o inglês John Dalton elaborou a primeira TEORIA ATÔMICA. Dalton dizia que a matéria é formada por átomos, que são esferas maciças, indivisíveis, imutáveis e que não podem ser criadas , nem destruídas. Ele também percebeu que os átomos poderiam se unir, formando novas substâncias!
Logo após, tivemos a Teoria Atômica de Thompson em 1898. Thompson percebeu que quando se esfrega uma caneta algumas vezes no cabelo, ela fica eletricamente carregada e atrai pequenos pedaços de papel. Se a caneta pode ser carregada, é porque seu átomos, por sua vez, possuem carga. Foi pensando desta maneira que Thompson chegou a conclusão que os átomos não eram indivísíveis, conforme era dito nos ultimos pensamentos sobre o átomo! Tinha alguma coisa presente nos átomos que permitia que estes pequenos pedaços de papel fossem atraídos!
Thompson chegou a conclusão, com esta experiencia e outras mais complexas, de que o átomo possuía pequenas partículas de carga negativa : os elétrons!
O modelo químico de Thompson é conhecido como Pudim de Passas.

Modelo Atômico de Thompson - Pudim de Passas.
Em 1908, Ernest Rutherford realizou uma experiência para mostrar que o átomo realmente era como Thompson dizia. Rutherford utilizou um material radioativo que emitia partículas ALFA , que por sua vez possuem carga positiva.
Ele esperava que as partículas alfa atravessassem a lâmina diretamente ,porém algumas foram rebatidas.
Como algumas partículas foram rebatidas, a explicação que o Rutherford encontrou é que elas deveriam ter se chocado com algo e, provavelmente,com algo de massa superior que a fizesse bater e voltar. Essa região foi denominada NÚCLEO.
Se a partícula alfa possui carga positiva e ao chegar no núcleo a mesma foi "repelida", isto significa que o núcleo também possui carga positiva. E os elétrons então estariam ao redor do núcleo em uma área muito superior do que a área do núcleo, pois foram poucas as partículas que rebateram em sua experiência.
Porém Bohr, já havia concordado com o modelo de Rutherford, mas entendeu que este modelo precisava ser aprimorado em alguns aspectos.
Bohr percebeu que os elétrons não estavam dispersos no átomo ao redor do núcleo como dizia Rutherford.
Afirmou que os elétrons estavam em órbitas circulares denominadas camadas ou níveis de energia.
Ele percebeu também que enquanto ele gira,ele se mantém na mesma camada. Porém se o elétron fica excitado, ele pula para um nível de energia mais externo. Esta situação é extremamente instável, assim, logo ele volta para um nível inferior de energia, portanto uma camada mais interna, e libera aquela energia em excesso em forma de luz ! Este é o modelo atual, denominado Modelo Atômico de Rutherford-Bohr
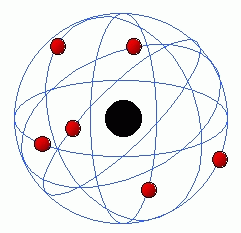 também conhecido como Modelo Planetário.
também conhecido como Modelo Planetário.
Aprendemos também que no núcleo do átomo, nós temos os neutrôns, de carga neutra e os prótons, que dão o caráter de carga positiva do núcleo.
Os elétrons, no átomo, estariam nas órbitas, e sua região de presença é denominada ELETROSFERA!
Além disso vimos alguns casos de NOMENCLATURA QUÍMICA. Aprendemos que todos os elementos da tabela períodica, ou seja, os elementos que conhecemos da Terra, possuem por sua vez um número atômico e um número de Massa..
No vestibular, o número atômico estará embaixo do símbolo do elemento, e o numero de massa acima (ao contrário da tabela períodica de nossa apostila).
O número atômico, representado pela letra Z, corresponde ao número de prótons, que em um átomo neutro, ou seja, que não está perdendo nem ganhando elétrons, este número de protons será igual ao número de elétrons! Em átomos NAO NEUTROS, aprenderemos a calcular o numero de elétrons na próxima aula.
Aprendemos também que a massa de um elemento químico se concentra principalmente no núcleo. Ou seja, quem dá a massa dos elementos, sao as partículas que se encontram no núcleo, que sabemos que são os prótons e neutrons. Portanto a formula da massa é M= Prótons + Neutrons!
O valor da massa fica acima do nome do elemento nas tabelas períodicas em geral, o número de prótons é o número atômico, que fica abaixo do elemento na tabela períodica, assim, podemos calcular o número de neutrons, dentre outras continhas pequenas que são exigidas no vestibular e que exercitaremos em aula daqui para frente!
É importante lembrar também que o número da Massa é representado pela letra A!
Esta foi nossa aula da semana passada! Qualquer dúvida, postem aqui, ou me perguntem na quinta feira!!!
Bons estudos alunos!!!
Prof. Ana
Na última aula conversamos bastante sobre os modelos atômicos que tivemos antes de chegar no átomo que conhecemos hoje!
A primeira forma em explicar o que seria o que hoje conhecemos como átomo surgiu na Grécia por Leucipo e Demócrito. Nesta época poucos acreditavam que os átomos de fato existiam, porém Leucipo e Demócrito mostravam já uma idéia primitiva de que os átomos existiam. Eles diziam que os materiais encontrados na natureza eram formados por partículas muito pequenas,invisíveis e indivisíveis!
Este modelo durou tempo considerável até que em 1808, o inglês John Dalton elaborou a primeira TEORIA ATÔMICA. Dalton dizia que a matéria é formada por átomos, que são esferas maciças, indivisíveis, imutáveis e que não podem ser criadas , nem destruídas. Ele também percebeu que os átomos poderiam se unir, formando novas substâncias!
Logo após, tivemos a Teoria Atômica de Thompson em 1898. Thompson percebeu que quando se esfrega uma caneta algumas vezes no cabelo, ela fica eletricamente carregada e atrai pequenos pedaços de papel. Se a caneta pode ser carregada, é porque seu átomos, por sua vez, possuem carga. Foi pensando desta maneira que Thompson chegou a conclusão que os átomos não eram indivísíveis, conforme era dito nos ultimos pensamentos sobre o átomo! Tinha alguma coisa presente nos átomos que permitia que estes pequenos pedaços de papel fossem atraídos!
Thompson chegou a conclusão, com esta experiencia e outras mais complexas, de que o átomo possuía pequenas partículas de carga negativa : os elétrons!
O modelo químico de Thompson é conhecido como Pudim de Passas.

Modelo Atômico de Thompson - Pudim de Passas.
Em 1908, Ernest Rutherford realizou uma experiência para mostrar que o átomo realmente era como Thompson dizia. Rutherford utilizou um material radioativo que emitia partículas ALFA , que por sua vez possuem carga positiva.
Ele esperava que as partículas alfa atravessassem a lâmina diretamente ,porém algumas foram rebatidas.
Como algumas partículas foram rebatidas, a explicação que o Rutherford encontrou é que elas deveriam ter se chocado com algo e, provavelmente,com algo de massa superior que a fizesse bater e voltar. Essa região foi denominada NÚCLEO.
Se a partícula alfa possui carga positiva e ao chegar no núcleo a mesma foi "repelida", isto significa que o núcleo também possui carga positiva. E os elétrons então estariam ao redor do núcleo em uma área muito superior do que a área do núcleo, pois foram poucas as partículas que rebateram em sua experiência.
Porém Bohr, já havia concordado com o modelo de Rutherford, mas entendeu que este modelo precisava ser aprimorado em alguns aspectos.
Bohr percebeu que os elétrons não estavam dispersos no átomo ao redor do núcleo como dizia Rutherford.
Afirmou que os elétrons estavam em órbitas circulares denominadas camadas ou níveis de energia.
Ele percebeu também que enquanto ele gira,ele se mantém na mesma camada. Porém se o elétron fica excitado, ele pula para um nível de energia mais externo. Esta situação é extremamente instável, assim, logo ele volta para um nível inferior de energia, portanto uma camada mais interna, e libera aquela energia em excesso em forma de luz ! Este é o modelo atual, denominado Modelo Atômico de Rutherford-Bohr
 também conhecido como Modelo Planetário.
também conhecido como Modelo Planetário.Aprendemos também que no núcleo do átomo, nós temos os neutrôns, de carga neutra e os prótons, que dão o caráter de carga positiva do núcleo.
Os elétrons, no átomo, estariam nas órbitas, e sua região de presença é denominada ELETROSFERA!
Além disso vimos alguns casos de NOMENCLATURA QUÍMICA. Aprendemos que todos os elementos da tabela períodica, ou seja, os elementos que conhecemos da Terra, possuem por sua vez um número atômico e um número de Massa..
No vestibular, o número atômico estará embaixo do símbolo do elemento, e o numero de massa acima (ao contrário da tabela períodica de nossa apostila).
O número atômico, representado pela letra Z, corresponde ao número de prótons, que em um átomo neutro, ou seja, que não está perdendo nem ganhando elétrons, este número de protons será igual ao número de elétrons! Em átomos NAO NEUTROS, aprenderemos a calcular o numero de elétrons na próxima aula.
Aprendemos também que a massa de um elemento químico se concentra principalmente no núcleo. Ou seja, quem dá a massa dos elementos, sao as partículas que se encontram no núcleo, que sabemos que são os prótons e neutrons. Portanto a formula da massa é M= Prótons + Neutrons!
O valor da massa fica acima do nome do elemento nas tabelas períodicas em geral, o número de prótons é o número atômico, que fica abaixo do elemento na tabela períodica, assim, podemos calcular o número de neutrons, dentre outras continhas pequenas que são exigidas no vestibular e que exercitaremos em aula daqui para frente!
É importante lembrar também que o número da Massa é representado pela letra A!
Esta foi nossa aula da semana passada! Qualquer dúvida, postem aqui, ou me perguntem na quinta feira!!!
Bons estudos alunos!!!
Prof. Ana
terça-feira, 28 de fevereiro de 2012
Quinta Feira está chegando!
Boa tarde alunos.
Nossa aula de quinta feira está chegando!
Não deixem de fazer os exercícios da primeira aula para relembrarem.
Química é um processo construtivo. De conceitos mais básicos, vamos a conceitos mais complexos, portanto, formem uma base rígida dos conceitos básicos!
Espero vocês na Quinta!
O tema será Atomística e muitos exercícios!
Até mais!
Nossa aula de quinta feira está chegando!
Não deixem de fazer os exercícios da primeira aula para relembrarem.
Química é um processo construtivo. De conceitos mais básicos, vamos a conceitos mais complexos, portanto, formem uma base rígida dos conceitos básicos!
Espero vocês na Quinta!
O tema será Atomística e muitos exercícios!
Até mais!
sábado, 25 de fevereiro de 2012
Ciência
Cientistas Australianos Criam Menor Transistor do Mundo
Por Folha Online
Cientistas australianos construíram o menor transistor do mundo a partir de um único átomo, o que representa um passo importante rumo ao desenvolvimento dos futuros computadores quânticos, informaram nesta segunda-feira à imprensa local.
O diminuto aparelho eletrônico tem um único átomo de fósforo, o qual é colocado com muita precisão em um cristal de silício, publicou o portal de notícias do "Sydney Morning Herald".
No passado já tinham sido desenvolvidos aparelhos compostos por um único átomo, embora eles tivessem um erro de dez nanômetros no posicionamento de átomos, uma situação que afetava seu funcionamento.
O avanço dos cientistas australianos consistiu em colocar com "excelente precisão" o átomo de fósforo, assegurou a chefe do projeto e diretora do Centro de Computação Quântica da Universidade de Nova Gales do Sul e chefe do projeto, Michelle Simmons, segundo o SMH.
Para este projeto foi usado um microscópio de varredura por tunelamento para substituir um de seis átomos de silício por um de fósforo com uma precisão maior a meio nanômetro.
Assim, este único átomo de fósforo foi colocado entre dois pares de eletrodos, o primeiro a 20 nanômetros de distância e o outro a 100 nanômetros, explicou o SMH.
Ao aplicar voltagens ao longo dos eletrodos, o nanoaparelho operou como um transístor que amplia e muda os sinais eletrônicas, segundo a pesquisa publicada na revista "Nature Nanotechnology".
Este nanotransistor representa um grande passo rumo ao desenvolvimento de computadores quânticos, aparelhos de grande poder que permitirão realizar cálculos, quase de forma instantânea, que atualmente os computadores mais avançados não podem realizar.
Calcula-se que ainda deverão passar cerca de 20 anos antes que este tipo de computadores quânticos possam estar ao alcance do público.
Por Folha Online
Cientistas australianos construíram o menor transistor do mundo a partir de um único átomo, o que representa um passo importante rumo ao desenvolvimento dos futuros computadores quânticos, informaram nesta segunda-feira à imprensa local.
O diminuto aparelho eletrônico tem um único átomo de fósforo, o qual é colocado com muita precisão em um cristal de silício, publicou o portal de notícias do "Sydney Morning Herald".
No passado já tinham sido desenvolvidos aparelhos compostos por um único átomo, embora eles tivessem um erro de dez nanômetros no posicionamento de átomos, uma situação que afetava seu funcionamento.
O avanço dos cientistas australianos consistiu em colocar com "excelente precisão" o átomo de fósforo, assegurou a chefe do projeto e diretora do Centro de Computação Quântica da Universidade de Nova Gales do Sul e chefe do projeto, Michelle Simmons, segundo o SMH.
Para este projeto foi usado um microscópio de varredura por tunelamento para substituir um de seis átomos de silício por um de fósforo com uma precisão maior a meio nanômetro.
Assim, este único átomo de fósforo foi colocado entre dois pares de eletrodos, o primeiro a 20 nanômetros de distância e o outro a 100 nanômetros, explicou o SMH.
Ao aplicar voltagens ao longo dos eletrodos, o nanoaparelho operou como um transístor que amplia e muda os sinais eletrônicas, segundo a pesquisa publicada na revista "Nature Nanotechnology".
Este nanotransistor representa um grande passo rumo ao desenvolvimento de computadores quânticos, aparelhos de grande poder que permitirão realizar cálculos, quase de forma instantânea, que atualmente os computadores mais avançados não podem realizar.
Calcula-se que ainda deverão passar cerca de 20 anos antes que este tipo de computadores quânticos possam estar ao alcance do público.
terça-feira, 21 de fevereiro de 2012
Um pouco de notícia
"Quase 25% do solo do planeta já sofreu alguma deterioração"
O problema ambiental não está apenas na água ou no ar. De acordo com um relatório da Nações Unidas, 24% do solo do planeta já sofreu algum tipo de deterioração.
A informação é do relatório anual do Unep (Programa de Ambiente das Nações Unidas), divulgado ontem.
O texto mostra que práticas recentes (nos últimos 25 anos) especialmente na atividade agrícola têm estragado e poluído o solo em diversas partes do planeta.
De acordo com o documento, a erosão provocada pela agricultura é até cem vezes mais intensa do que o processo erosivo "natural" do solo.
O problema disso é que o solo com erosão perde uma quantidade significativa de carbono para atmosfera -componente importante para o crescimento vegetal.
O Unep manifestou ainda uma preocupação com as usinas nucleares que estão sendo desativadas desde o acidente em uma usina nuclear de Fukushima, no Japão.
Em março de 2011, a usina foi atingida por um terremoto seguido de um tsunami e houve vazamento nuclear. Desde então, vários países declararam que fechariam suas usinas nucleares.
De acordo com o documento das Nações Unidas, 138 reatores foram fechados apenas neste ano, em 19 países.
Os desmantelamento dos reatores -que tem alto risco de contaminação do solo e custa cerca de 10% a 15% da implantação da usina- só foi concluída em 17 deles.
Fonte: Folha de S. Paulo.
O problema ambiental não está apenas na água ou no ar. De acordo com um relatório da Nações Unidas, 24% do solo do planeta já sofreu algum tipo de deterioração.
A informação é do relatório anual do Unep (Programa de Ambiente das Nações Unidas), divulgado ontem.
O texto mostra que práticas recentes (nos últimos 25 anos) especialmente na atividade agrícola têm estragado e poluído o solo em diversas partes do planeta.
De acordo com o documento, a erosão provocada pela agricultura é até cem vezes mais intensa do que o processo erosivo "natural" do solo.
O problema disso é que o solo com erosão perde uma quantidade significativa de carbono para atmosfera -componente importante para o crescimento vegetal.
O Unep manifestou ainda uma preocupação com as usinas nucleares que estão sendo desativadas desde o acidente em uma usina nuclear de Fukushima, no Japão.
Em março de 2011, a usina foi atingida por um terremoto seguido de um tsunami e houve vazamento nuclear. Desde então, vários países declararam que fechariam suas usinas nucleares.
De acordo com o documento das Nações Unidas, 138 reatores foram fechados apenas neste ano, em 19 países.
Os desmantelamento dos reatores -que tem alto risco de contaminação do solo e custa cerca de 10% a 15% da implantação da usina- só foi concluída em 17 deles.
Fonte: Folha de S. Paulo.
sábado, 18 de fevereiro de 2012
Aulas 1 e 2
Nossas duas primeiras aulas tiveram como idéia o nivelamento em Química de vocês!
Que tal relembrarmos?
1) Os estados físicos da matéria possuem uma relação direta com a energia cinética das moléculas!
Baixa energia cinética - Estado sólido
Alta energia cinética - Estado gasoso.
2) As mudanças de estado físico ocorrem por variações de temperatura e pressão..
3) Conceitos Básicos:
- Ponto de Fusão : Temperatura em que o sólido transforma-se em líquido
- Ponto de Ebulição : Momento em que o líquido transforma-se em gasoso
- Substância simples: Subtância que contém apenas um grupo de partículas. Exemplo: NH3
- Mistura : Composta por duas ou mais substâncias simples.
A mistura pode ser heterogênea, quando as substâncias não formam uma camada homogênea. Exemplo: Oleo e Agua.
Ou pode ser homogênea, quando é imperceptível diferenciação entre as susbtâncias. Exemplo: Agua e açúcar.
4) Curva de Aquecimento
4a) de uma substância simples:
Os pontos de fusão e de ebulição são bem definidos..
4b) de uma mistura eutética:
O ponto de fusão não é constante e passa a ser apenas um intervalo de fusão, enquanto o ponto de ebulição é constante.
Alunos, qualquer dúvida, me perguntem.
Resolvam os exercícios da apostila!
Atenciosamente,
Prof. Ana
Que tal relembrarmos?
1) Os estados físicos da matéria possuem uma relação direta com a energia cinética das moléculas!
Baixa energia cinética - Estado sólido
Alta energia cinética - Estado gasoso.
2) As mudanças de estado físico ocorrem por variações de temperatura e pressão..
3) Conceitos Básicos:
- Ponto de Fusão : Temperatura em que o sólido transforma-se em líquido
- Ponto de Ebulição : Momento em que o líquido transforma-se em gasoso
- Substância simples: Subtância que contém apenas um grupo de partículas. Exemplo: NH3
- Mistura : Composta por duas ou mais substâncias simples.
A mistura pode ser heterogênea, quando as substâncias não formam uma camada homogênea. Exemplo: Oleo e Agua.
Ou pode ser homogênea, quando é imperceptível diferenciação entre as susbtâncias. Exemplo: Agua e açúcar.
4) Curva de Aquecimento
4a) de uma substância simples:
Os pontos de fusão e de ebulição são bem definidos..
4b) de uma mistura eutética:
Possui apenas o ponto de fusão constante. O ponto de ebulição não é constante e passa a ser apenas um intervalo.
4c) de uma mistura azeotrópica:
Alunos, qualquer dúvida, me perguntem.
Resolvam os exercícios da apostila!
Atenciosamente,
Prof. Ana
À pedidos...
Boa noite queridos alunos! A pedido de vocês, fiz este blog como forma de mantermos uma relação mais direta , e assim, consigamos um aprendizado em conjunto e melhor !
Sempre irei postar resumos, exercícios e curiosidades que possam ser úteis no vestibular!
Não se esqueçam que, em caso de dúvida, espero que vocês não hesitem em me enviar um email.
Relembrando, meu endereço eletrônico é ana.barboza@usp.br
Bom ano letivo à todos!
Busquem seus sonhos....
Com Carinho,
Prof. Ana
Sempre irei postar resumos, exercícios e curiosidades que possam ser úteis no vestibular!
Não se esqueçam que, em caso de dúvida, espero que vocês não hesitem em me enviar um email.
Relembrando, meu endereço eletrônico é ana.barboza@usp.br
Bom ano letivo à todos!
Busquem seus sonhos....
Com Carinho,
Prof. Ana
Assinar:
Postagens (Atom)